O Diretriz da UE sobre medicamentos falsificados (FMD) faz com que os envolvidos na cadeia de suprimentos farmacêuticos comerciais pensem em sistemas de serialização, rastreamento e acompanhamento. Para as cadeias de suprimentos de ensaios clínicos, o foco está mais na rotulagem de produtos individuais. Isso inclui a impressão de rótulos e a verificação do conteúdo dos rótulos, que desempenham papéis importantes no cumprimento dos requisitos regulamentares.
Na Parte 1 desta série de duas partes do blog, discutimos os desafios envolvidos na rotulagem de produtos medicinais usados em estudos clínicos. Na Parte 2, discutiremos as soluções para superar esses desafios, incluindo o uso da tecnologia Systech Marcação e verificação manual T11
Os regulamentos da UE para rotulagem de produtos medicinais experimentais (IMPs) e produtos medicinais auxiliares (AMPs) usados em estudos clínicos no setor farmacêutico são rigorosos - e por um bom motivo. Os rótulos fornecem aos administradores de estudos clínicos e aos participantes informações essenciais, como dosagem, instruções de administração, instruções de armazenamento e validade. Qualquer erro no rótulo pode comprometer a segurança dos participantes e a integridade dos dados do estudo clínico.
Estar em conformidade com as normas de rotulagem nem sempre é fácil. Os requisitos podem ser extremamente complexos, especialmente quando os estudos clínicos estão sendo realizados em vários países. A maioria dos países exige AMP e Rótulos IMP e outras informações a serem fornecidas em seu idioma ou idiomas preferidos. Cada país, bem como os locais específicos das instalações, também pode ter seus próprios requisitos de rotulagem.
O que complica ainda mais a rotulagem de ensaios clínicos é o fato de que quaisquer atualizações no medicamento ou no seu manuseio durante ou entre as fases do ensaio clínico exigem alterações no rótulo. Por exemplo, novas informações sobre a estabilidade do ME geralmente surgem durante os ensaios clínicos. Quando isso acontece, os MEs devem ser rotulados novamente com datas de validade e outros conteúdos atualizados.
Qualquer mudança abre a oportunidade para erros, reforçando a importância da verificação do rótulo no processo de impressão. Embora os benefícios dos rótulos eletrônicos (eLabels) tenham o potencial de reduzir os erros, a UE ainda exige que Rótulos IMP ser impresso.
Além disso, as tiragens de etiquetas usadas em testes clínicos são normalmente pequenas em comparação com as de etiquetas farmacêuticas padrão. Isso torna impraticável o investimento em grandes sistemas integrados de impressão e verificação, sem mencionar que a maioria das organizações que realizam testes clínicos não tem espaço para equipamentos de grande porte. A terceirização é uma opção, mas a necessidade de acomodar mudanças frequentes no conteúdo do rótulo torna essa escolha ineficiente e aumenta o risco de atrasos.
Como se as organizações já não tivessem muito com o que lidar em termos de rótulos para estudos clínicos, agora elas também precisam lidar com a Regulamento de Ensaios Clínicos da União Europeia 536/2014 (EU CTR). Embora tenha o objetivo de harmonizar as regras para a realização de estudos clínicos em toda a UE, ela também gera confusão.
A CTR da UE entrou em vigor em 31 de janeiro de 2022, substituindo a Diretiva de Ensaios Clínicos da União Europeia (EU CTD) 2001/20/EC.Os requisitos de rotulagem de produtos da UE deixaram de fazer parte dos requisitos de GMP descritos no Anexo 13 para Medicamentos em Investigação (seções 26-33) e passaram a fazer parte do texto legislativo do CTR, artigos 66-70. Os requisitos específicos para a rotulagem de produtos experimentais para estudos clínicos na UE estão detalhados no Anexo VI do CTR da UE. Há um período de transição de três anos para sua adoção. A seguir, apresentamos uma visão geral dos requisitos de rotulagem de ME nos termos da CTR da UE.
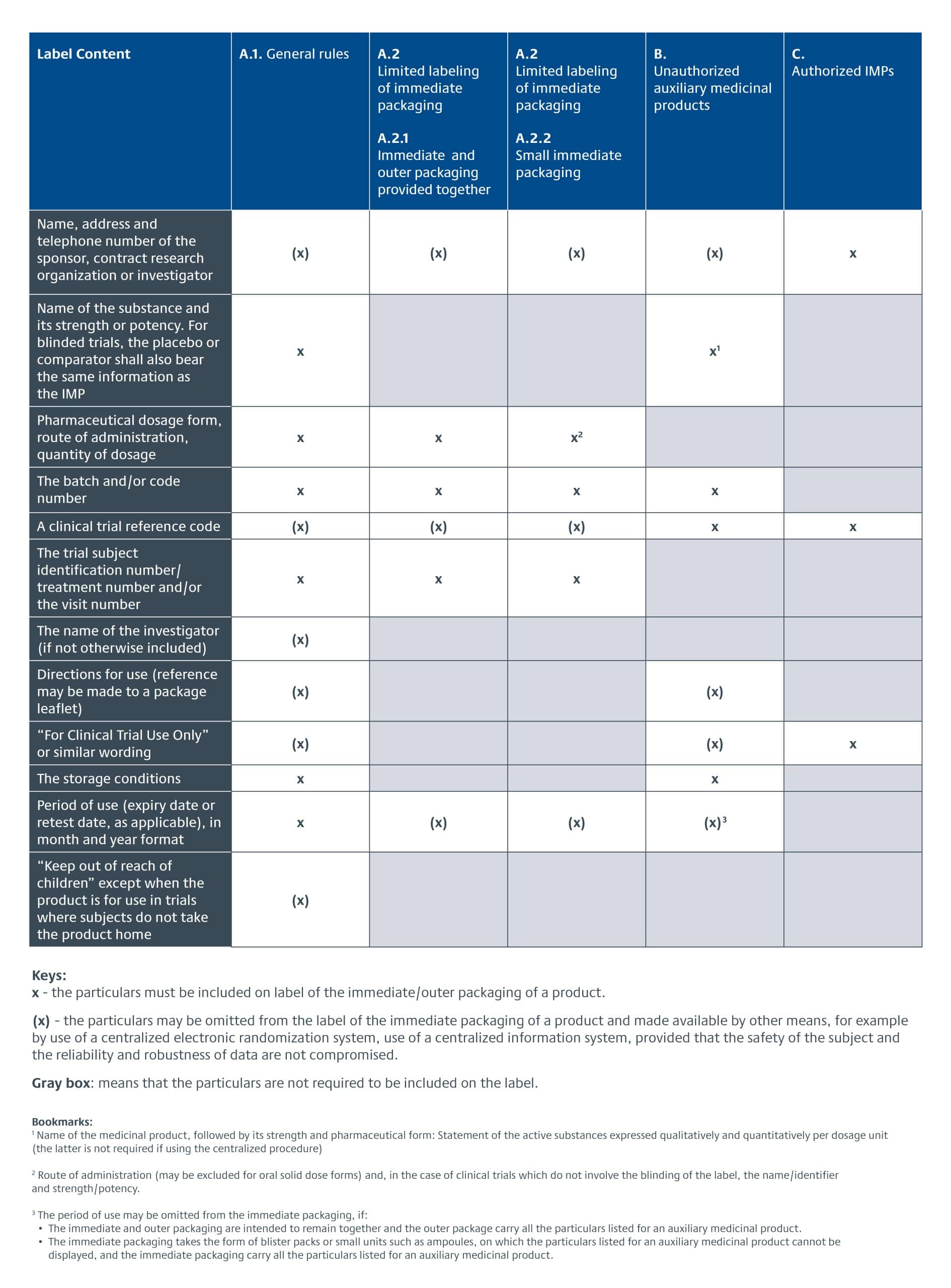
Além disso, o novo Sistema de Informações de Ensaios Clínicos (CTIS) entrou em operação em 31 de janeiro de 2023. Ele agora é o ponto de entrada único para o envio de dados e informações relacionadas a estudos clínicos exigidos pelo CTR da UE. Os patrocinadores de pesquisas clínicas tiveram um ano para fazer a transição para o novo sistema.
A maior confusão está em saber se o EU CTR ou o EU CTD se aplica aos requisitos de rotulagem de ME. Os estudos clínicos apresentados sob a CTR da UE devem estar em conformidade com os novos requisitos de rotulagem.
A partir de 31 de janeiro de 2024 - o fim do período de transição para o CTIS - todos os envios de ensaios clínicos deverão ser enviados por meio do CTIS e estarão sujeitos aos regulamentos do CTR da UE. Os estudos clínicos existentes autorizados pelo EU CTD, que podem incluir qualquer estudo enviado antes de 31 de janeiro de 2024, podem manter sua rotulagem original.
Mais um fator a ser considerado com relação aos requisitos de rotulagem para estudos clínicos: a pessoa qualificada (QP). De acordo com a legislação da União Europeia (UE), o QP certifica que cada lote de um produto medicinal atende a todas as disposições exigidas quando liberado de uma instalação de fabricação na UE ou importado para a UE. Embora o CTR da UE tenha sido adotado, a forma como ele é interpretado pode variar de um QP para outro. É imperativo que o patrocinador do produto medicinal e a QU concordem com a estratégia e o conteúdo da rotulagem para evitar problemas de conformidade e atrasos no cronograma.
Há também uma emenda ao Anexo VI que foi adotada em setembro de 2022 e entrou em vigor após a publicação no Jornal Oficial da União Europeia em 15 de novembro de 2022. Ela elimina a exigência de incluir o prazo de validade na embalagem imediata de alguns MEs usados em estudos clínicos.
Apesar dos desafios, a capacidade de produzir etiquetas sem erros, conforme necessário e quando necessário, é fundamental. Tenha em mente que:
Em Parte 2 Nesta série do blog, discutiremos algumas das opções para a produção de rótulos de ensaios clínicos e os recursos que devem ser procurados para atender aos critérios mencionados acima.