Die EU-Richtlinie über gefälschte Arzneimittel (Falsified Medicines Directive, FMD) veranlasst diejenigen, die an der kommerziellen pharmazeutischen Lieferkette beteiligt sind, über Serialisierungs- und Track-and-Trace-Systeme nachzudenken. Bei den Lieferketten für klinische Prüfungen liegt der Schwerpunkt eher auf der individuellen Produktkennzeichnung. Dies umfasst sowohl den Druck von Etiketten als auch die Überprüfung des Etiketteninhalts, die beide eine wichtige Rolle bei der Erfüllung der gesetzlichen Anforderungen spielen.
In Teil 1 dieser zweiteiligen Blogserie erörtern wir die Herausforderungen bei der Kennzeichnung von Arzneimitteln, die in klinischen Studien verwendet werden. In Teil 2 werden wir Lösungen zur Bewältigung dieser Herausforderungen erörtern, einschließlich der Verwendung des T11 Manual Mark & Verify
Die EU-Vorschriften für die Kennzeichnung von Prüfpräparaten (IMPs) und Hilfsarzneimitteln (AMPs), die bei klinischen Prüfungen in der Pharmaindustrie verwendet werden, sind streng - und das aus gutem Grund. Die Etiketten versorgen die Verwalter klinischer Prüfungen und die Probanden mit wichtigen Informationen wie Dosierung, Verabreichungsanweisungen, Lagerungsanweisungen und Verfallsdatum. Fehler auf dem Etikett können die Sicherheit der Teilnehmer und die Integrität der Daten der klinischen Prüfung gefährden.
Die Einhaltung der Kennzeichnungsvorschriften ist nicht immer einfach. Die Anforderungen können äußerst komplex sein, insbesondere wenn klinische Prüfungen in mehreren Ländern durchgeführt werden. Die meisten Länder verlangen, dass AMP- und IMP-Etiketten und andere Informationen in der/den bevorzugten Sprache(n) bereitgestellt werden. Jedes Land sowie die einzelnen Prüfzentren können auch ihre eigenen Kennzeichnungsvorschriften haben.
Eine weitere Komplikation bei der Kennzeichnung klinischer Prüfungen ist die Tatsache, dass alle Aktualisierungen des Arzneimittels oder seiner Handhabung während oder zwischen den Phasen der klinischen Prüfung eine Änderung der Kennzeichnung erforderlich machen. So ergeben sich beispielsweise während der klinischen Prüfungen häufig neue Informationen über die Stabilität von Prüfpräparaten. In diesem Fall müssen die Prüfpräparate mit aktualisierten Verfallsdaten und anderen Inhalten neu gekennzeichnet werden.
Jede Änderung birgt die Gefahr von Fehlern, was die Bedeutung der Etikettenüberprüfung im Druckprozess unterstreicht. Obwohl die Vorteile elektronischer Etiketten (eLabels) das Potenzial haben, Fehler zu verringern, verlangt die EU immer noch, dass IMP-Etiketten gedruckt werden.
Außerdem sind die Druckauflagen für Etiketten, die in klinischen Versuchen verwendet werden, im Vergleich zu denen für Standard-Pharmaetiketten in der Regel klein. Das macht Investitionen in große integrierte Druck- und Prüfsysteme unpraktisch, ganz zu schweigen davon, dass die meisten Organisationen, die klinische Prüfungen durchführen, keinen Platz für große Anlagen haben. Outsourcing ist eine Option, aber die Notwendigkeit, häufige Änderungen des Etiketteninhalts zu berücksichtigen, macht dies zu einer ineffizienten Wahl und erhöht das Risiko von Verzögerungen.
Als ob die Organisationen nicht schon genug mit der Kennzeichnung klinischer Prüfungen zu tun hätten, müssen sie sich jetzt auch noch mit der Verordnung 536/2014 der Europäischen Union über klinische Prüfungen (EU CTR). auseinandersetzen. Sie soll zwar die Regeln für die Durchführung klinischer Prüfungen in der gesamten EU harmonisieren, sorgt aber auch für Verwirrung.
Die EU-CTR trat am 31. Januar 2022 in Kraft und ersetzte die Richtlinie der Europäischen Union über klinische Prüfungen (EU CTD) 2001/20/EG.Die EU-Anforderungen an die Produktkennzeichnung sind nicht mehr Teil der GMP-Anforderungen in Anhang 13 für Prüfpräparate (Abschnitte 26-33), sondern Teil des Gesetzestextes der CTR, Artikel 66-70. Die spezifischen Anforderungen an die Kennzeichnung von Prüfpräparaten für klinische Prüfungen in der EU sind in Anhang VI der EU-Zulassungsordnung aufgeführt. Es gibt eine dreijährige Übergangsfrist für die Annahme der Richtlinie. Im Folgenden wird ein Überblick über die Anforderungen an die Kennzeichnung von Prüfpräparaten gemäß EU-CTR gegeben.
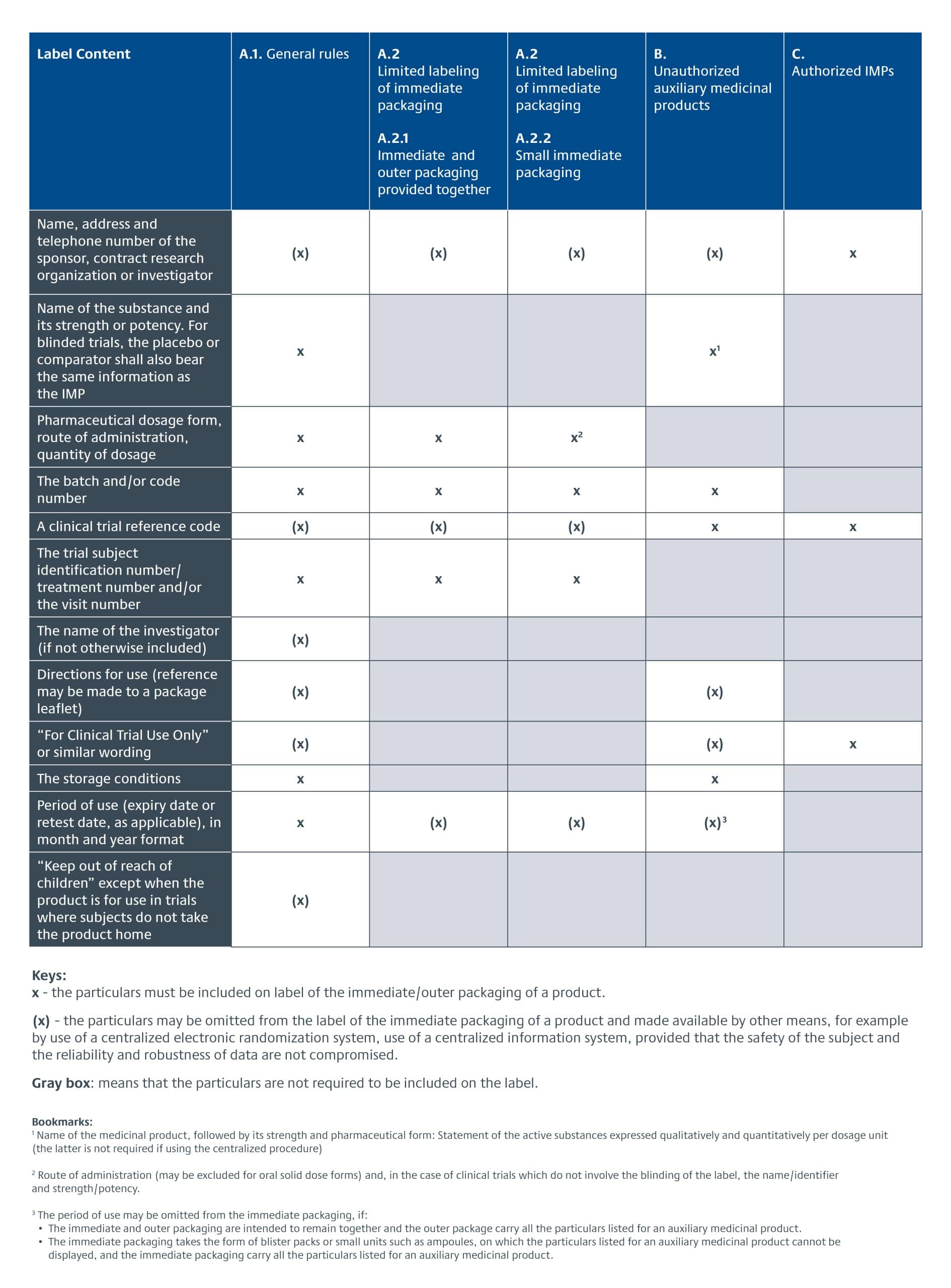
Darüber hinaus wurde am 31. Januar 2023 das neue Informationssystem für klinische Prüfungen (CTIS) in Betrieb genommen. Es ist nun die zentrale Anlaufstelle für die Einreichung von Daten und Informationen über klinische Prüfungen, die von der EU-CTR verlangt werden. Die Sponsoren von klinischen Prüfungen hatten ein Jahr Zeit, um auf das neue System umzustellen.
Die größte Verwirrung herrscht bei der Frage, ob die EU-CTR oder die EU-CTD für die Kennzeichnungsvorschriften für Prüfpräparate gilt. Klinische Prüfungen, die unter der EU-CTR eingereicht werden, müssen den neuen Kennzeichnungsanforderungen entsprechen.
Ab dem 31. Januar 2024 - dem Ende des Übergangszeitraums zum CTIS - müssen alle Anträge für klinische Prüfungen über das CTIS eingereicht werden und unterliegen den EU-CTR-Vorschriften. Bestehende klinische Prüfungen, die im Rahmen der EU-CTD genehmigt wurden, zu denen auch solche gehören könnten, die vor dem 31. Januar 2024 eingereicht wurden, können ihre ursprüngliche Kennzeichnung behalten.
Ein weiterer Faktor, der bei den Kennzeichnungsvorschriften für klinische Prüfungen zu berücksichtigen ist: die qualifizierte Person (QP). Nach dem Recht der Europäischen Union (EU) bescheinigt die QP, dass jede Charge eines Arzneimittels alle vorgeschriebenen Bestimmungen erfüllt, wenn sie von einer Produktionsstätte in der EU freigegeben oder in die EU eingeführt wird. Die EU-Kontrollverordnung wurde zwar angenommen, doch ihre Auslegung kann von einer QP zur anderen variieren. Der Sponsor des Arzneimittels und die QP müssen sich unbedingt auf die Kennzeichnungsstrategie und den Inhalt einigen, um Probleme mit der Einhaltung der Vorschriften und zeitliche Verzögerungen zu vermeiden.
Es gibt auch eine Änderung von Anhang VI, die im September 2022 angenommen wurde und mit der Veröffentlichung im Amtsblatt der Europäischen Union am 15. November 2022 in Kraft tritt. Damit entfällt die Anforderung, das Verfallsdatum auf der Primärverpackung einiger in klinischen Prüfungen verwendeter IMPs anzugeben.
Trotz dieser Herausforderungen ist die Fähigkeit, bei Bedarf fehlerfreie Etiketten zu produzieren, von entscheidender Bedeutung. Denken Sie daran, dass:
In Teil 2 dieser Blogserie werden wir einige der Optionen für die Erstellung von Etiketten für klinische Studien und die zu berücksichtigenden Merkmale, die die oben genannten Kriterien erfüllen können, erörtern.